Конспект. Технология оксидного керамического топлива
|
Курс: |
Производство керамического ядерного топлива |
|
Модуль 4: |
Технология оксидного керамического топлива |
|
Автор |
Гузеев Виталий Васильевич, д.т.н., профессор |
|
|
|
|
Рецензенты |
|
|
|
|
|
Длительность (рекомендуемая) |
2 час |
|
|
|
|
Главная цель |
По окончании изучения темы обучаемый будет способен рассказать о способах получения диоксида урана. |
|
|
|
|
Промежуточные цели |
|
4.1. Оксиды урана. Строение и свойства
В таблице 4.1 представлены все известные на сегодня оксиды урана. С точки зрения теории валентности трудно объяснить такие формулы, но если принять существование неорганических полимеров, то возможно существование гомологического ряда оксидов урана, описываемого общей формулой UnO2n+1, где n – целое число.
Таблица 4.1. Оксиды урана
|
Фаза |
Отноше-ние O/U |
Сингония |
Параметры кристаллической решетки |
Плот-ность г/см3 | |||
|---|---|---|---|---|---|---|---|
|
|
|
|
а, нм |
b, нм |
С. нм |
L, град |
|
|
UO2 |
2,0 |
Кубич. |
0,5470 |
- |
- |
- |
10,96 |
|
α-U4O9 |
2,25 |
- |
2,176 |
- |
- |
- |
11,3 |
|
β-U4O9 |
2,25 |
Ромбич. |
0,5444 |
- |
- |
- |
- |
|
γ-U4O9 |
2,25 |
- |
- |
- |
- |
90,07 |
- |
|
U16O37 |
2,31 |
Тетраг. |
0,5407 |
- |
0,5497 |
- |
- |
|
α-U3O7 |
2,30 |
- |
0,5447 |
- |
0,5400 |
- |
11,5 |
|
β-U3O7 |
2,34 |
- |
0,538 |
- |
0,5556 |
- |
11,5 |
|
γ-U3O7 |
2,31 |
- |
1,074 |
- |
0,554 |
- |
10,5 |
|
U8O19 |
2,37 |
Моноклин. |
0,5378 |
0,5559 |
0,5378 |
92,29 |
- |
|
α-U2O5 |
2,5 |
Гексагон. |
0,3885 |
- |
0,4082 |
- |
- |
|
β-U2O5 |
2,5 |
- |
0,3813 |
- |
1,318 |
- |
- |
|
γ-U2O5 |
2,5 |
Моноклин. |
0,4410 |
0,5481 |
0,5410 |
90,49 |
- |
|
U8O21 |
2,61 |
Орторомбич. |
0,6751 |
0,3176 |
0,8286 |
- |
- |
|
α-U3O8 |
2,67 |
Орторомбич. |
0,6716 |
1,193 |
0,4144 |
- |
8,39 |
|
β-U3O8 |
2,67 |
Орторомбич. |
0,705 |
1,142 |
0,829 |
- |
- |
|
γ-U3O8 |
2,67 |
Гексагон. |
0,878 |
- |
0,918 |
- |
- |
|
α-U12O35 |
2,9 |
Ромбич. |
0,691 |
0,392 |
0,416 |
- |
8,41 |
|
UO3 |
3,0 |
- |
- |
- |
- |
- |
6,8 |
|
α-UO3 |
3,0 |
Орторомбич. |
0,3913 |
0,6936 |
0,4167 |
- |
8,4 |
|
|
|
Гексагон. |
0,3971 |
- |
0,4168 |
- |
- |
|
β-UO3 |
3,0 |
Моноклин. |
1,034 |
1,433 |
0,391 |
99,03 |
8,25 |
|
|
|
Орторомбич. |
- |
- |
- |
- |
- |
|
γ-UO3 |
3,0 |
Орторомбич. |
1,361 |
1,548 |
0,750 |
- |
- |
|
|
|
Ромбич. |
0,971 |
0,977 |
1,992 |
- |
8,02 |
|
|
|
Псевдомонокл. |
0,689 |
0,689 |
1,994 |
90,57 |
8,01 |
|
δ-UO3 |
3,0 |
Кубич. типа ReO3 |
0,46 |
- |
- |
- |
- |
|
ε-UO3 |
3,0 |
Триклин. |
0,4002 |
0,3841 |
- |
- |
6,68 |
|
|
|
|
|
|
0,4165 |
α=98,1 β=90,2 γ=120,2 |
|
|
η-UO3 |
3,0 |
Орторомбич. |
0,7511 |
0,5466 |
0,5224 |
- |
8,85 |
Все восемь начальных гомологов этого ряда реально существуют в виде оксидов. На сегодняшний день их насчитывается 29. Следует обратить внимание, что триоксид урана существует в семи модификациях, а формула у всех одна UO3.
Такие оксиды как UO3, U3O8, U2O5, U5O13, U3O7, U7O16, U4O9, UO2 и UO реально существуют. Но сточки зрения теории валентности они не объяснимы. Хотя U3O8 может быть представлен как смесь двух оксидов: 2UO3∙UO2, наличие двухвалентного или трехвалентного урана не обнаружено, все атомы одинаковы. Так же как в оксиде U3O7 – UO3·2UO2.
Принято в настоящее время наряду с существованием нестехиометрической формулы диоксида урана UO2,07 или UO2,17, другие оксиды, например U3O8 (три уран окто оксид), обозначать формулой UO2,67. Нестехиометрическая запись наиболее полно представляет соединение.
Диоксид урана как материал для ядерного топлива, представляет особый интерес.
4.2. Способы получения оксидов урана
Существует несколько вариантов технологий получения диоксида урана. Гидрометаллургическая технология – ”мокрая” (или так называемый АДУ-процесс) и газофазная технология.
Своим названием АДУ-процесс обязан аммоний диуранату, являющемуся исходным продуктом для получения оксидных соединений урана, в том числе, и керамического UO2. Хотя такое соединение в реальных технологических схемах, как правило, не образуется, в технической литературе это название прочно закрепилось за способами получения керамического диоксида урана, в которых имеется промежуточная стадия осаждения полиуранатов аммония.
Обычно под АДУ-процессом подразумевают классическую схему получения керамического UO2 из UF6 (гидролиз UF6 в воде или растворе аммиака – осаждение полиураната аммония – сушка – прокалка – восстановление), которая была разработана еще в середине 50-х, годов и реализована на Маллинкродском заводе в США. Долгое время этот UO2 считался эталоном керамического диоксида урана. За истекшие 25 лет технология АДУ-процесса была значительно усовершенствована. Усовершенствования коснулись не только аппаратурного оформления процесса, но и были направлены на стабилизацию свойств порошка UO2, создание крупномасштабных технологических линий. В целом же химизм и последовательность операций не претерпели существенных изменений.
В газовых методах гидролиз UF6 проводят при повышенных температурах (обычно при 473 – 973 К). Поэтому правильнее этот процесс назвать пирогидролизом. Реакция пирогидролиза, проводимая в отсутствие водорода при повышенных температурах, достаточно проста, протекает практически мгновенно и трактуется однозначно как ведущая к образованию уранилфторида. Но в реальных процессах в присутствии водорода приходится считаться с существованием двух многоступенчатых цепочек превращений UF6, ведущих к образованию твердых промежуточных соединений.
Цепочка превращений: UF6 → UO2F2 → UO2:
|
UF6 + 2H2O = UO2F2 + 4HF |
|
UO2F2 + H2 = UO2 + 2HF |
|
UO2F2 + H2O = UO3 + 2HF |
|
UO3 + H2 = UO2 + H2O |
|
UO2F2 + 2/3H2O +1/3H2 = UO2.67 + 2HF |
|
UO2.67 + 2/3H2 = UO2 + 2/3H2O |
|
UO2F2 + H2 = 1/2UO2 + 1/2UF4 + H2O |
|
1/2UF4 + H2O = 1/2UO2 + 2HF |
В результате нескольких вариантов реакций, превращение гексафторида урана заканчивается образованием диоксида урана.
Рассмотрим гидролиз гексафторида урана:
UF6 + 2Н2О = UO2F2 + 4HF
UF6 + 6НNO3 = UO2(NO3)2 + 6HF
UF6 + 4NH4OH + Al(NO3)3 = UO2(NO3)2 + NH4NO3 + (NH4)3AlF6
растворимый
UF6 + 4NH4OH + 2Al(NO3)3 = UO2(NO3)2 + 4NH4NO3 + 2AlF3 + 2Н2О
нерастворимый осадок
На первой стадии образуется уранил фторид. И при осаждении полиураната фтор захватывается и обнаруживается уже в готовом диоксиде урана. Чтобы избежать этого в раствор для осаждения добавляют нитрат алюминия, и фтор при этом связывается в комплексное соединение и остается в растворе.
АДУ-процесс, реализуемый во фторидных системах, предназначен для переработки UF6, содержащего повышение концентрации 235U либо обедненного по изотопу 235U. Получаемый порошок UO2 с содержанием до 5% 235U используется для изготовления таблетированного топлива энергетических реакторов типа PWR и BWR, а порошок UO2, обедненный по изотопу 235U, – как топливо зоны воспроизводства реакторов на быстрых нейтронах. Однако область применения полиуранатов аммония как исходного продукта для получения керамического UO2 не ограничивается фторидными системами, а распространяется и на нитратные системы. Заметна доля в атомной энергетике реакторов, в которых ядерным топливом является природный уран (тяжеловодные реакторы типа CANDU).
Технологические схемы получения UO2 из природного сырья существенно отличаются от схем получения UO2 из UF6. Прежде всего в этом случае сняты ограничения размеров аппаратуры, поскольку проблема критичности в системах на природном уране практически отсутствует. Кроме того, в схеме предусматриваются аффинажные операции, так как в качестве исходного продукта применяются химические концентраты урана, содержащие значительные количества примесей.
При получении керамического UO2 из химконцентратов, растворение последних ведут в НNО3. После экстракционной очистки растворов и реэкстракции урана из органической фазы деионизированной водой, подкисленной НNО3, получают чистые растворы уранилнитрата. Из растворов осаждают полиуранат аммония, из которого затем получают UO2. Таким образом, в схеме получения керамического UO2 из природного сырья имеется стадия осаждения полиуранатов аммония из нитратных растворов. Эта стадия сохраняется и при переработке брака и отходов таблетированного топлива экстракционным методом.
Таким образом, появляются два варианта АДУ-процесса: осаждение полиураната аммония из фторидных и нитратных растворов.
Керамические свойства UO2, определяются главным образом физико-химическими свойствами полиуранатов аммония. Следует учесть, что рентгено- и ИК-спектрометрические исследования показывают, что структуры полиуранатов аммония, осаждаемых из нитратных и фторидных растворов, идентичны.
4.3. Полиуранаты аммония, их структура и свойства
Полиуранаты аммония нашли широкое применение на стадии переработки сырьевых материалов, в процессах аффинажа, при получении и переработке ядерного топлива. Наибольшее внимание полиуранаты аммония привлекли к себе в связи с развитием ядерной энергетики, поскольку уже на первом этапе ее развития зарекомендовали себя как отличный исходный продукт для получения керамического UO2. В связи с расширением масштабов производства и общей тенденцией к ужесточению требований, предъявляемых потребителями к керамическому топливу. Потребовались изучение природы полиуранатов, морфологии и структуры порошков, правильная оценка многочисленных факторов, влияющих на свойства получаемых полиуранатов и оксидов, и т.д.
Обычно к уранатам относят как безводные соли, так и соли, осаждаемые из водных растворов. В состав последних входят аква-, гидроксо- и оксогруппы. Для технологии керамического UO2 наибольший интерес представляют уранаты второй группы, в первую очередь полиуранаты аммония. Cтруктура уранатов, осаждаемых из гидролизатов, представлена на рисунке 4.1.
Рис. 4.1. Структура полиураната
Система UO2(NO3)2 – NH4OH – H2О. Механизм образования уранатов аммония заключается в том, что формирование уранатов идет за счет включения в решетку исходного дигидроксоаквауранилата ионов аммония по катионообменному механизму:
UO2(ОН)2 +xNH4+ → UO2(ОН)2-х(O-NH4+)x +xH+ (4.1)
При добавлении к раствору уранилнитрата газообразного или водного аммиака образуется неравновесная система. Скорость достижения равновесия зависит от различных факторов, в частности от химического состава системы и температуры процесса. Общий механизм проникновения ионов аммония в молекулу биядерного комплекса заключается в обмене протонов гидроксильных мостиков на ионы аммония с одновременной частичной заменой координированных молекул воды на молекулы аммиака. После достижения отношения NH4+/U в осадке 0,5 содержание аммиака в осадке стремится к нулю. По современным воззрениям, полиуранаты представляют собой гомогенную систему с непрерывно меняющимися отношениями NH4+/U и H2О/U. Каждому отношению соответствует свое гомогенное и однофазное соединение. Такой взгляд на систему полиуранатов аммония получил надежное экспериментальное подтверждение методами ИК-спектрометрического и рентгеноБыли фазового анализов. Одной из причин образования неравновесной многофазной системы, по мнению экспериментаторов, является сложная кинетика формирования осадка, определяемая его разнородным гранулометрическим составом, морфологией частиц и степенью их агрегирования. Было установлено, что более крупные частицы в растворе аммиака гидратируются медленнее, но сорбируют аммиак с большой скоростью.
Растворимость полиуранатов аммония определяется величиной рН. Так, при рН = 3,5 растворимость урана составляет примерно 16 г/л, а при рН = 9 – лишь 10-14 г/л.
Осаждение полиуранатов аммония является типичным кристаллизационным процессом и, следовательно, подчиняется основным закономерностям таких процессов. В частности, в условиях низких рН при более слабом пересыщении, устанавливается такое соотношение скоростей образования зародышей и их роста, которое благоприятствует формированию достаточно крупных кристаллитов.
Влияние рН осаждения на удельную поверхность полиураната аммония показано на рисунке 4.2. При рН> 7,0 наблюдается значительное увеличение удельной поверхности и соответствующее уменьшение размера кристаллитов. Отметим еще раз, что размер кристаллитов является важным параметром, определяющим керамические свойства порошка UO2. В общем случае можно утверждать, что чем ниже размер кристаллитов полиураната аммония, тем выше спекаемость UO2, но тем хуже технологические свойства осадка, в частности, его фильтруемость.
Рис. 4.2. - Влияние рН осаждения на удельную поверхность полиураната аммония
Осаждение полиуранатов в этом исследовании проводили для сравнения из разбавленных (0,95 г/л) и концентрированных (52 г/л) растворов. Размеры кристаллитов в полиуранатах, осажденных из разбавленных растворов, были малы (0,1–0,2 мкм), тогда как кристаллиты в полиуранате, осажденном из сравнительно концентрированных растворов, имели большие размеры (0,2–0,5 мкм). Кроме того, в концентрированных растворах наблюдалась повышенная агломерация первичных частиц. Такое влияние концентрации урана на крупность кристаллов соли не укладывается в обычные представления о процессах кристаллизации. Причина этого заключается в том, что скорость диффузии ионов UO22+ в нитратном растворе значительно ниже скорости диффузии анионов и определяет скорость роста кристаллитов. Повышение концентрации ионов UO22+ способствует увеличению диффузионного потока и ускорению роста кристаллитов. При осаждении полиуранатов из растворов, не столь резко различающихся между собой по концентрации урана, указанные отличия в значительной степени сглаживаются.
Химический состав уранатов, осажденных аммиаком, соответствует брутто формуле:
(0,55–0,72)NH4·UO3·(0,2–0,43)F· x(OH)·уH2О
Состав уранатов, осажденных при добавлении раствора в аммиак, соответствует формуле:
(0,33–0,66)NH4·UO3·(0,1–0,44)F·x(OH) ·уH2О.
Значимой корреляции между предельными значениями аммиака и фтора в соли и условиями осаждения не установлено.
Термическое разложение полиуранатов аммония – на первый взгляд достаточно простая операция в технологическом цикле получения керамического диоксида урана. Но значение этой операции трудно переоценить. Именно при осаждении и прокалке закладываются важные свойства порошка, которые позволяют отнести его к керамическому сорту. Это насыпная плотность, удельная поверхность, дисперсность, пирофорность, текучесть.
Поэтому разработке теоретических основ термического разложения полиуранатов аммония в последнее время уделяется большое внимание. Разложение можно производить в аммиаке, азоте, водороде, инертной среде. При этом свойства порошка изменяются.
Процесс разложения полиуранатов аммония на воздухе и в инертной среде протекает в пять стадий:
- удаление адсорбционной воды (T = 298-403 К)
- удаление части конституционной воды (T = 403-473 К)
- удаление остальной части конституционной воды и части аммиака
(T = 473-623 К) - образование b-UO3 (на воздухе), самовосстановление и образование U3O8 (в инертной среде) (T = 623-723 К)
- образование U3O8 (на воздухе) и потеря кислорода при повышенных температурах с образованием U3O8–х (T > 723 К)
В водороде процесс термического разложения происходит через те же стадии, но последняя стадия – восстановление U3O8 до UO2 – протекает через образование промежуточных фаз UO2,25 и UO2 + х.
4.4. Технологические схемы получения керамической UO2
по АДУ-процессу
На рисунке 4.3 представлена аппаратурная схема типичного процесса получения керамического диоксида урана.
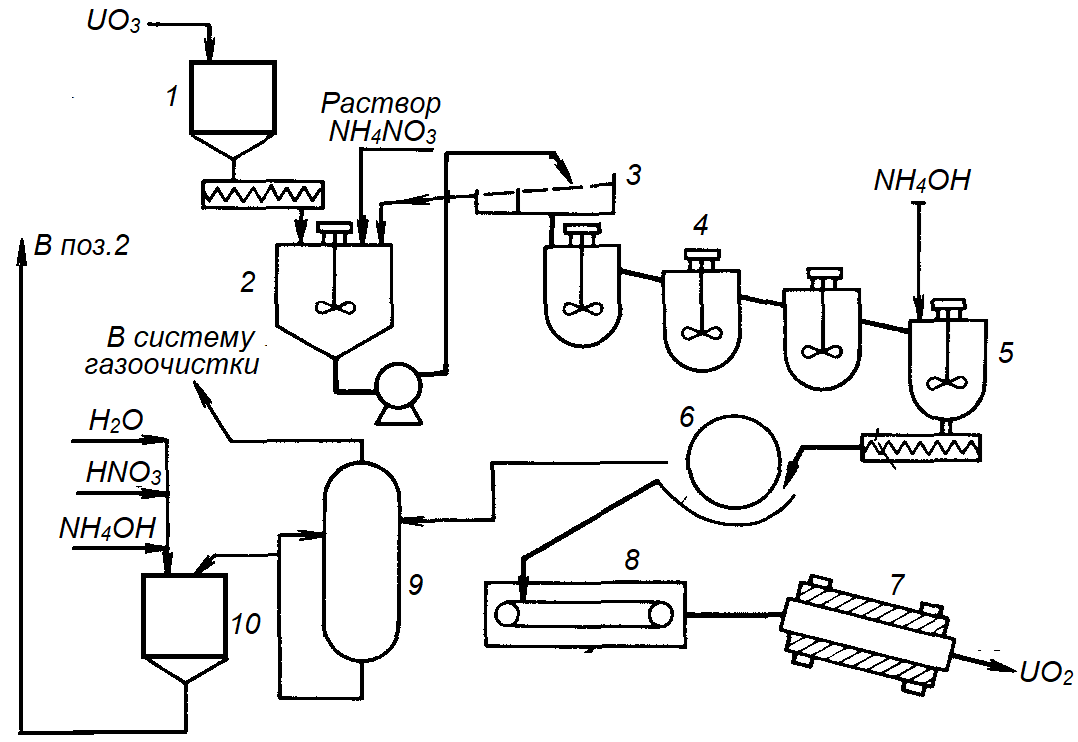
Рис.4.3. Аппаратурная схема типичного процесса получения керамической UO2:
1 – бункер-накопитель; 2 – реактор; 3 – сито; 4 – каскад реакторов; 5 – реактор для полного осаждения урана; 6 – барабанный вакуум-фильтр; 7 – печь восстановления;
8 – ленточная сушилка; 9 – испаритель; 10 – накопительная емкость, служащая также для доукрепления раствора NН4NО3.
Исходным продуктом в этом процессе является UO3, получаемый в аппаратах-денитраторах. Порошок UO3 по вакуумной линии поступает в бункер-накопитель, из которого он подается в емкость, где распульповывается раствором нитрата аммония с концентрацией примерно 200 г/л. Соотношение между UO3 и нитратом аммония может изменяться в широких пределах (от 0,5:1 до 10:1) и существенного значения не имеет. Если размеры частиц UO3 менее 100 меш, порошок подают непосредственно в каскад из четырех реакторов. Если в порошке имеются частицы размером более 100 меш, пульпу перекачивают на грохот с размером ячейки 100 меш. Верхний продукт возвращается в емкость, а нижний слив поступает на дальнейшую переработку. Условия обработки пульпы в каскаде реакторов: температура 353 К, длительность обработки 4 ч, рН = 2,9 – 3,0. Пульпа самотеком непрерывно перетекает по каскаду реакторов. В результате обменной реакции в растворе повышаются кислотность и соответственно растворимость урана. Поэтому в последний реактор каскада подают аммиак, поднимая рН до 8,0.
Затем пульпу перекачивают на барабанный вакуум-фильтр, осадок промывают водой. После промывки влажный полиуранат аммония выдавливают на ленточную сушилку, высушивают при 373 — 393 К и восстанавливают до UO2, как в АДУ-процессе. Нетрудно понять, что лежащая в основе АДУ-процесса обменная реакция (4.2) в сущности эквивалентна реакции (4.1) и заключается в замещении ионами NH4+ протонов в структуре гидрооксида урана.
6UO3+2NH4OH+H2O→6UO3·2NH3·xH2O+2HNO3+(n-x)H2O(4.2)
Таким образом, новый процесс является удачным подтверждением правильности современных воззрений на структуру полиураната аммония.
Заканчивается АУ-процесс сбором фильтрата и промывных вод со стадий обезвоживания осадка и его промывки в накопительную емкость, в которой проводят корректировку концентрации нитрата аммония до требуемой добавкой соответствующего реагента и раствор используют в следующем цикле. За счет рециркуляции количество требуемого для ведения процесса нитрата аммония сводится к минимуму.
В настоящее время АДУ технология имеет вспомогательное значение и используется при переработке бракованных таблеток.
На рисунках 4.4 и 4.5 приведены технологические и аппаратурные схемы получения диоксида урана газофазными методами.
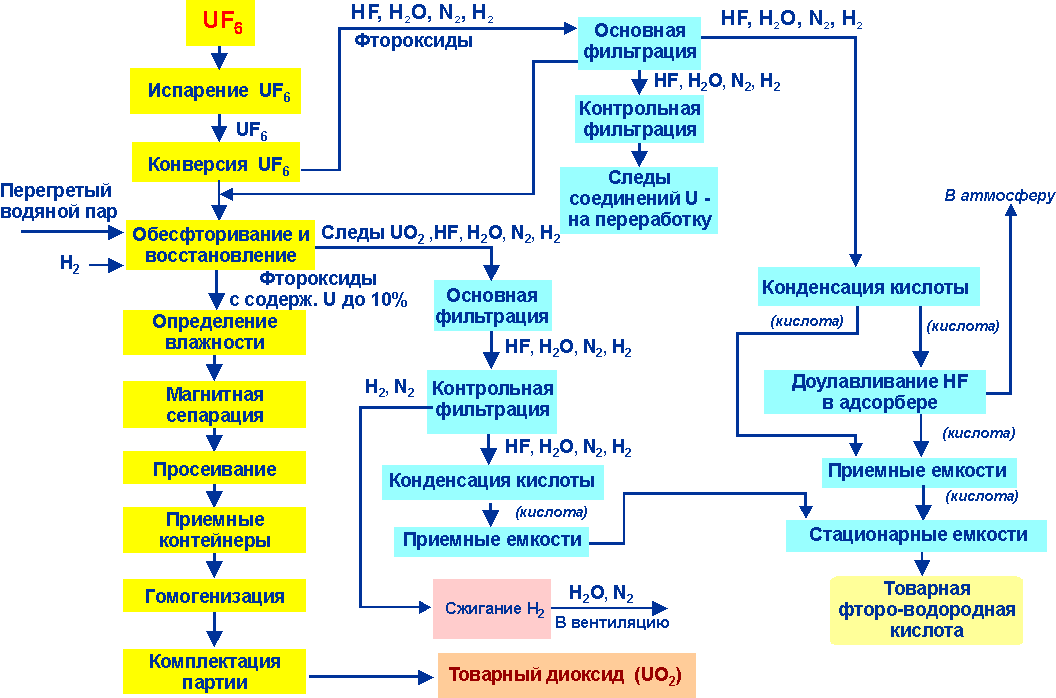
Рис.4.4. Схема переработки UF6 газопламенным методом («Сатурн»)
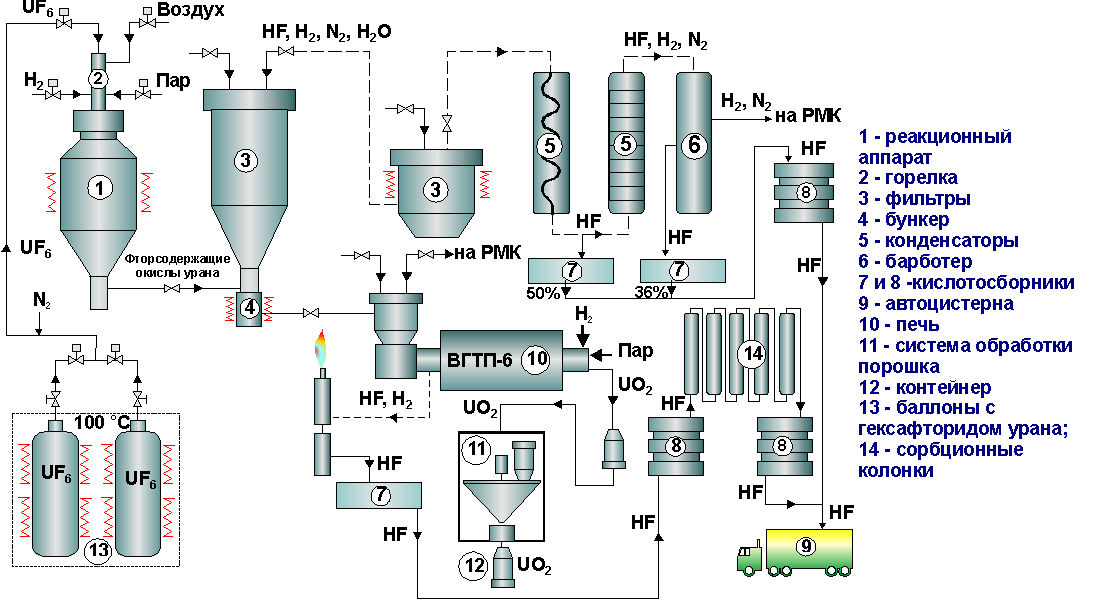
Рис.4.5. Аппаратурно-технологическая схема газопламенной переработки UF6 в UO2:
1 – реакционный аппарат; 2 – горелка; 3 – фильтры; 4 – бункер; 5 – конденсаторы;
6 – барботер; 7,8 – кислотосборники; 9 – автоцистерна; 10 – печь; 11 – система обработки порошка; 12 – контейнер; 13 – баллоны с гексафторидом урана;
14 – сорбционные колонки
Гексафторид урана испаряется из баллона (13), индукционным нагревом обязательно снизу вверх. Перегретый пар и водород подается в голову процесса (аппарат №1). Для горения водорода туда же подается воздух. Происходит обесфторивание. Образуется диоксид и оксифториды урана (твердая урансодержащая фаза). После конверсии гексафторида урана, твердые соединения урана улавливаются на фильтрах (3). Твердая фаза накапливается в контейнере (4). Затем через систему газоудаления урансодержащая фаза подается в печь. Туда же подаются водород и пары воды для восстановления и гомогенизации диоксида урана. Диоксид урана на выходе из печи затаривается в герметичный контейнер (12) и направляется на приготовление пресспорошка для прессования таблеток. Затем таблетки идут на спекание.
Пламенный реактор представляет собой вертикальную трубу, в верхней части которой смонтирована горелка, служащая для подачи в реактор смеси гексафторида урана с водородом и кислородом или воздухом (рисунок 4.6).
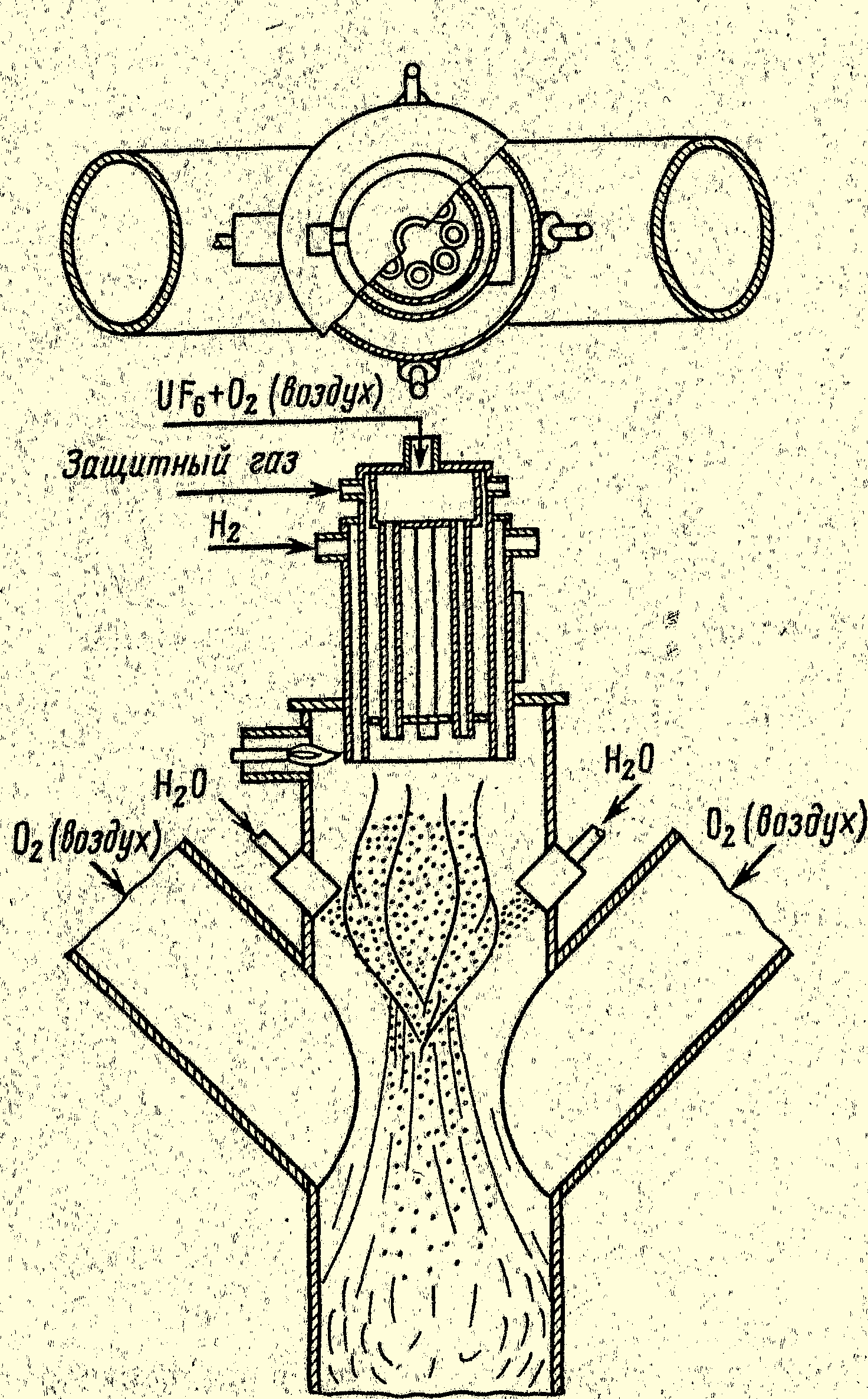
Рис.4.5. Схема головной части пламенного реактора
Эта смесь поступает в реакционную зону по трубам, расположенным по окружности реактора. Водород подают по внешнему кольцевому каналу. Важным условием успешной работы реактора является предотвращение преждевременного смешения компонентов пламени. В противном случае реакция может начаться вблизи от выходного сечения трубок, служащих для подачи реагентов, что неизбежно приведет к их закупорке и аварийной остановке реактора.
С целью разделения основных компонентов пламени в межтрубное пространство подают защитный газ (азот), который, проходя по кольцевому зазору вокруг газоподводящих трубок, создает зону, обедненную основными компонентами пламени.
Как уже было отмечено выше; получаемый в газопламенном реакторе продукт представляет собой смесь диоксида урана с промежуточными продуктами конверсии UF6 в U02, содержащую от 3-4 до 15 % фтора. Фтор находится в порошке как в связанном виде, так и в виде адсорбированного фтористого водорода. Термическая обработка порошков во вращающейся печи в атмосфере водорода в присутствии паров воды при температуре 1000-1270 К позволяет уменьшить содержание фтора до 3*10-3%. Порошки получаются мелкие - крупность частиц не превышает нескольких десятых микрона. Они хорошо прессуются и спекаются. Газы, содержащие фтористый водород, являются ценным продуктом. Фтористый водород конденсируется при температуре 19,5 ⁰С и может быть использован в производстве элементного фтора.
Вода, которая содержится в газовой смеси, образует со фтористым водородом азеатропные растворы. Ректификацией они не разделяются. Поэтому получаются два продукта: жидкий фтористый водород, полученный из газообразного фтористого водорода для производства фтора, и водный раствор (это плавиковая кислота), которые направляются в емкости для отправки потребителю.
В технологии также используют другую технологическую схему изготовления порошка диоксида урана путем переработки UF6 методом восстановительного пирогидролиза («сухая» конверсия, рисунок 4.7).
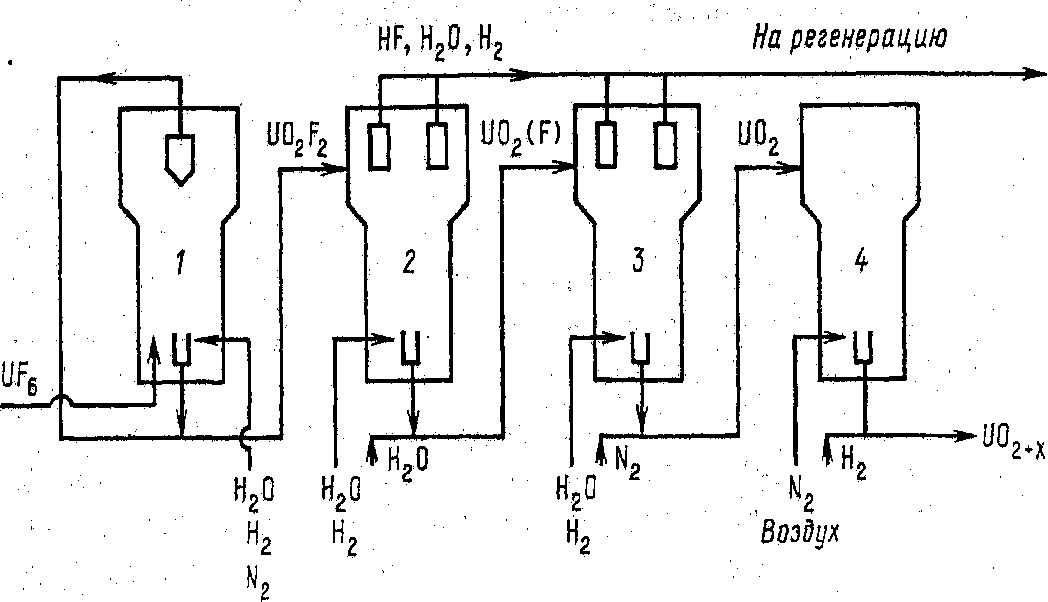
Рис.4.5. Схема установки пирогидролиза UF6 в кипящем слое: 1 – пирогидролиз;
2 – восстановление; 3 – обесфторивание; 4 – частичное окисление
Эта технология отличается в головной части. Основные аппараты представляют аппараты кипящего слоя. В результате взаимодействия всех нагретых газов образуется твердая фаза, которая испытывает цепочку превращений указанных на схеме, далее улавливается фильтрами и направляется в печь на восстановление и гомогенизацию диоксида урана. Газы перерабатываются аналогично предыдущей схеме.
В таблице 4.2 представлены преимущества и недостатки двух методов изготовления порошка диоксида урана: АДУ-технологии и газопламенная технология.
Таблица 4.2. Преимущества и недостатки АДУ-технологии и газопламенной технологии изготовления порошка диоксида урана
|
Метод изготовления порошка |
Преимущества |
Недостатки |
|---|---|---|
|
Гидролизно-экстракционная технология |
переработка различного сырья: легкий подбор коррозионно-стойких материалов; отсутствие проблемы улавливания и обезвреживания аэрозолей. |
большое количество технологических операций; большой набор технологического оборудования; большой объем сбросных вод; сложность переработки растворов с целью извлечения остаточного урана; трудность перехода с одного отсутствие технологии утилизации фтора |
|
Газопламенная технология
|
короткая технологическая цепочка; высокая степень автоматизации; малое количество отходов; высокая степень воспроизводи мости характеристик порошка; легкость перехода с одного обогащения по U235 на другое; утилизация HF. |
сырье – только UF6; необходимость применения коррозионностойкого (к фтору) оборудования; сложность системы улавливания аэрозолей. |